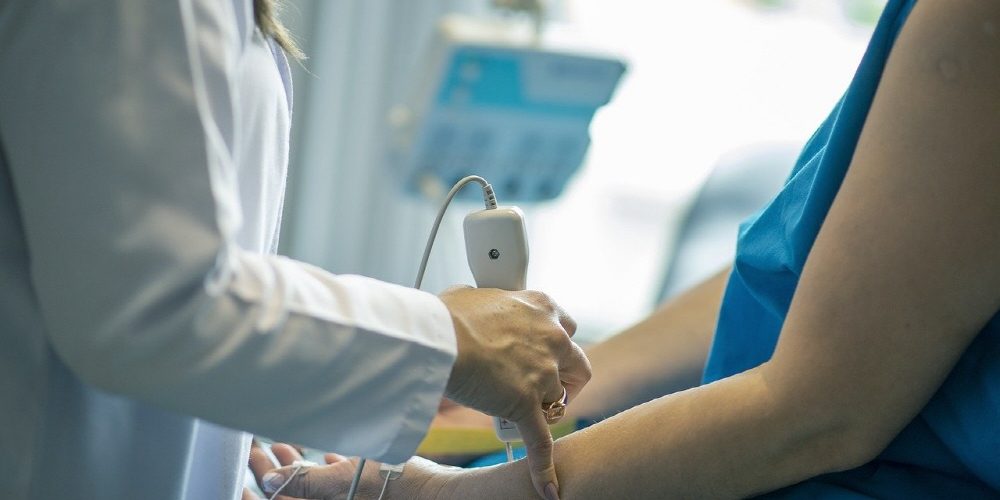
중국 과학기술 발전은 눈부셔서 AI 등 여러 분야에서 세계 최고 수준 영향력을 발휘하고 있다. 중국은 의약품 개발 분야에서도 그 영향력을 확대하고 있다.
대형 제약사는 자사에서 개발한 분자 뿐 아니라 다른 기업이나 연구기관이 개발한 분자를 구입해 의약품 개발 및 제조를 진행하는 경우가 많다. 대형 제약사가 구매한 분자 중 중국에서 개발된 분자가 차지하는 비율은 2020년경부터 급증하기 시작했고 2024년에는 전체 31%를 차지하게 됐다. 중국에서 시작된 임상시험 건수는 2017년에는 연간 600건이었지만 2023년에는 3배가 넘는 2,000건으로 증가했다.
중국에서 임상시험이 급증한 요인으로는 규제 완화가 꼽힌다. 중국 의약품 규제 당국인 NMPA는 2017년 규제 당국이 60일 이내에 이의를 제기하지 않으면 임상시험은 허가된 것으로 간주된다는 규정을 도입했다. 더불어 중국은 2017년에 의약품 규제 조화 국제회의(ICH)에 가입하고 해외 임상 데이터 수용을 가능하게 하는 규제 개정을 실시했다. 이런 규제 개혁으로 임상시험 착수와 의약품 승인 절차가 간소화됐으며 국제적인 투자를 유치하는 데 성공했다.
또 중국 임상시험은 피험자 수가 많다는 특징도 지닌다. 미국에서는 피험자 수가 1~~100명인 임상시험이 전체 4분의 3을 차지하는 반면 중국에서는 40% 이상 임상시험에서 피험자 수가 101명을 초과했다.
미국은 현대 의약품 개발 선구자지만 현재는 정체의 징후를 보이고 있다. 반면 중국은 임상시험 프로세스를 개혁해 효율성을 극대화하고 급속한 발전을 이뤘다는 지적이다. 이에 따라 임상시험 시작까지의 시간 단축과 해외 데이터의 효과적 활용 등이 필요하다고 분석하고 있다. 관련 내용은 이곳에서 확인할 수 있다.