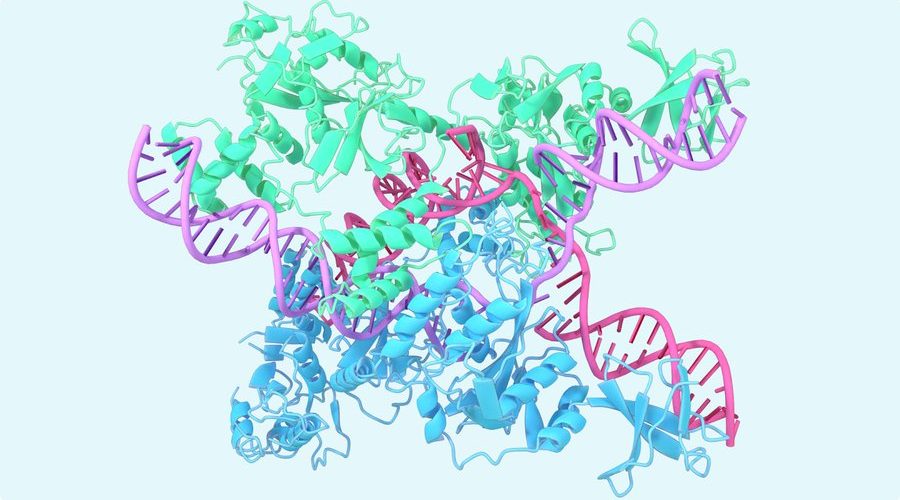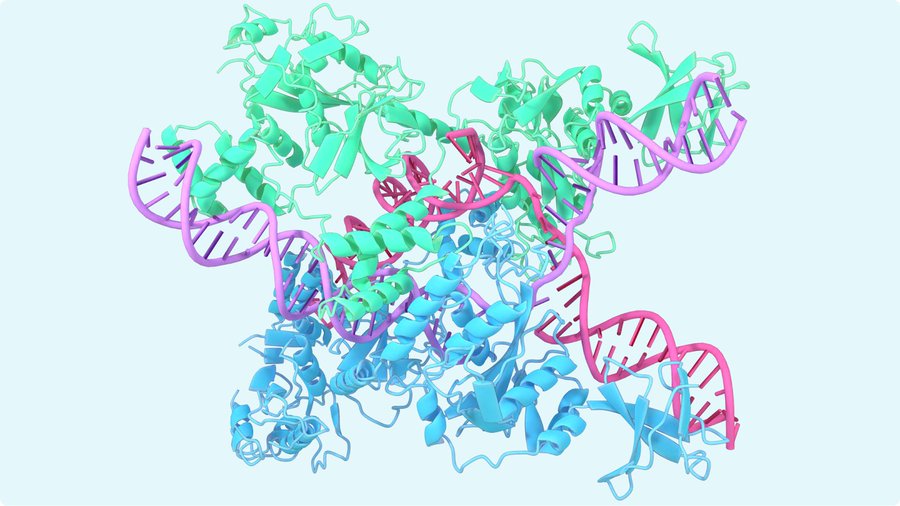
구글 딥마인드(Google DeepMind)가 2018년 아미노산 염기서열 정보로부터 단백질 입체 구조를 예측할 수 있는 AI인 알파폴드(AlphaFold)를 발표했다. 알파폴드는 이후에도 개선을 거듭해 2023년 10월 30일 릴리스된 알파폴드 최신 버전은 기존보다 예측 정밀도가 대폭 높아져 단백질 뿐 아니라 배위자(Ligand) 같은 생체 분자 예측도 가능해졌다고 한다.
근육 수축과 혈액 수송, 빛 감지, 음식 에너지 변환 등 모든 생물학적 과정과 관련한 단백질은 20가지 L-아미노산이 사슬 모양으로 연결된 입체 고분자 화합물이다. 지금까지 인간이 발견한 단백질 종류는 2억 개가 넘지만 입체 구조가 확인된 단백질은 소수다.
하지만 구글 딥마인드가 개발한 알파폴드는 지금까지 입체 구조가 불명했던 단백질 구조를 AI를 이용해 예측하고 있으며 2020년에는 알파폴드가 기존 저온전자현미경법 등 실험적 방법에 의한 단백질 입체 구조 해석이 같은 수준 정밀도를 기록한 것으로 보고됐다.
알파폴드는 단백질 폴딩 문제라는 오랫동안 생물학적으로 큰 문제가 되고 있는 아미노산 서열로부터 입에 구조 예측이 곤란하다는 문제를 해결할 수 있는 가능성에 대해 기대를 받고 있다. 지금까지 구글 딥마인드는 2020년 기존 알파폴드 향상 버전인 알파폴드2를 출시하고 2021년에는 알파폴드르 오픈소스화, 2023년 10월 31일 출시한 알파폴드 최신 버전은 세계 최대 생체분자 오픈 액세스 데이터베이스인 단백질 구조 데이터뱅크에 망라된 거의 모든 분자 입체 구조를 예측할 수 있는 것으로 보고됐다.
구글 딥마인드에 따르면 새로운 알파폴드에선 생체분자 복합체를 형성해 생물학적 목적을 완수하는 배위자, 리간드라고 불리는 물질이나 단백질이 만들어진 뒤 일어나는 화학 변화에 수반하는 분자 구조도 정확하게 예측할 수 있다고 한다.
지금까지 제약 연구자는 도킹 방법이라고 불리는 컴퓨터 시뮬레이션을 사용해 단백질과 리간드가 어떻게 상호 작용하는지 검토했다. 하지만 도킹법에선 단백질 구조 등이 중요해져 도킹법을 이용한 제약 기술에는 한계가 있었다. 새로운 알파폴드에선 단백질 구조 등은 AI가 자동으로 예측하기 때문에 지금까지 입체 구조가 밝혀지지 않았던 단백질 예측을 실시하는 동시에 단백질이나 핵산이 다른 분자와 어떻게 상호작용할지에 대한 자세한 시뮬레이션을 할 수 있다.
구글 딥마인드는 항체 결합 등 창약 관련한 다양한 단백질 구조 예측 문제에 대해 새로운 알파폴드는 기존 알파폴드 성적을 크게 웃돌고 있다면서 이번 알파폴드의 극적인 성능 향상은 인체를 구성하는 분자에 대한 과학적 이해가 크게 진행될 수 있으며 AI 유용성을 보여준다고 설명했다.
한편 구글 딥마인드는 신체 RNA 분자 구조를 예측하는 것에 대해 알파폴드가 기존 방법에 뒤떨어지고 있다는 걸 보고하고 해결을 위해 추가 연구를 실시하고 있다고 밝혔다. 또 구글 딥마인드 관련사인 아이소모픽랩스(Isomorphic Labs)는 이미 새로운 알파폴드를 치료제 설계에 도입했으며 알파폴드가 질병 치료에 중요한 다양한 분자 구조를 분석하는데 도움이 됐다고 보고했다.
데미스 하사비스 구글 딥마인드 CEO는 범용 인공지능이라는 다양한 분야에서 인간을 능가하는 성능을 갖춘 AI가 최종적으로 탄생할 것으로 예측하고 있으며 AI 폭주와 범죄에 사용되는 위험성을 우려하고 빠른 AI 규제 도입을 요구하고 있다. 관련 내용은 이곳에서 확인할 수 있다.